Nicolas Potier, Benjamin Touzé, Jean-Marc Lo-Guidice, Sébastien Anthérieu, Guillaume Grzych*
Le protoxyde d’azote (N2O) est un gaz utilisé en médecine pour ses propriétés anesthésiques et analgésiques et dans l’industrie comme gaz comburant ou propulseur. Ce gaz est également disponible pour un usage alimentaire à la vente en libre-service. Depuis quelques années, son utilisation est de plus en plus détournée pour un usage récréatif. Entre 2020 et 2021, le nombre de cas graves d’intoxications a augmenté de 320 % en France, démontrant une préoccupation majeure de santé publique. De plus, c’est un problème pour la sécurité routière avec une augmentation du nombre d’accidents de la route en lien avec la consommation de ce gaz. Le protoxyde d’azote provoque des effets à court terme (euphorie, désorientations, etc.) et à long terme (troubles neurologiques sensitifs et moteurs, thrombose). Ce gaz agit sur le système nerveux central, induisant des effets anxiolytique, anesthésique, antidépresseur et analgésique. Le dosage du protoxyde d’azote est difficile à cause de son élimination rapide. L’exploration biologique repose ainsi sur les anomalies secondaires liées à l’inactivation de la vitamine B12 : augmentation du taux d’acide méthylmalonique et d’homocystéine. Cependant ces deux marqueurs biologiques ne sont pas spécifiques à l’intoxication au protoxyde d’azote. Pour permettre une meilleure prise en charge des patients, il est nécessaire de trouver de nouveaux marqueurs biologiques plus spécifiques des intoxications au protoxyde d’azote.
Protoxyde d’azote –Historique, usages et propriétés physicochimiques
Le protoxyde d’azote (N2O) a été découvert pour la première fois en 1772 par le chimiste Joseph Priestley.
Durant le xixe siècle, il était utilisé à des fins récréatives au sein des fêtes foraines britanniques à cause de son effet euphorisant. Son action analgésique a été constatée accidentellement par Horace Wells en 1844, lors d’un spectacle. Wells essaya ce gaz pour s’arracher une molaire, confirmant son action anesthésique. Il utilisera ensuite le protoxyde d’azote sur ses patients. En 1845, Horace Wells a voulu montrer son applicabilité thérapeutique à la communauté médicale mais cela fut un échec.
Ce n’est qu’en 1867 qu’il arriva en France [1]. De nos jours, le protoxyde d’azote est toujours utilisé comme analgésique léger sous le nom de MEOPA (pour Mélange équimolaire oxygène protoxyde d’azote). Le protoxyde d’azote a également d’autres utilisations.
Dans l’industrie alimentaire, il est utilisé comme un agent de moussage et de mélange (E942). Il est également utilisé dans l’industrie automobile, dans les systèmes de propulsion des voitures de course. Dans l’industrie spatiale, le protoxyde d’azote peut être utilisé comme oxydant liquide favorisant la propulsion des fusées [2]. Depuis quelques années, son utilisation est de plus en plus détournée. Initialement librement vendu sous forme de capsules de siphon à crème chantilly, de nouveaux contenants ont vu le jour pour des utilisations uniquement “récréatives”. Les capsules se sont transformées en bonbonnes (contenance équivalente à 80-100 capsules) et en tank (400-600 capsules) (figure 1), rendant le gaz moins cher avec une utilisation plus simplifiée entraînant des utilisations plus fréquentes et prolongées.
Le protoxyde d’azote a pour formule chimique N2O, c’est un gaz incolore et inodore ayant une saveur et une odeur légèrement sucrée. Il est plus dense que l’air et soluble dans l’eau. C’est un gaz comburant et oxydant lui conférant sa propriété propulsante.
Le protoxyde d’azote est stable à température ambiante [3].

Épidémiologie et conséquences cliniques
D’après les données recueillies au cours de l’année 2022 par Santé publique France, environ 4,3 % des adultes ont expérimentés le protoxyde d’azote au moins une fois dans leur vie. Parmi la population entre 18 et 24 ans, la prévalence est plus élevée avec 13,7 % ayant consommé du protoxyde d’azote au moins une fois dans leur vie et 3,2 % en ayant consommé au cours de l’année. Les consommateurs sont majoritairement masculins pour une moyenne d’âge de 25 ans [4]. Le dernier rapport de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) de 2021 montre une augmentation significative du nombre de cas d’intoxications en France, liées à la consommation récréative du protoxyde d’azote. Le nombre de cas graves est passé de 82 à 265 entre 2020 et 2021, soit une augmentation de 320%, avec des consommations quotidiennes dans la moitié des cas et pour préférence la consommation par bonbonne (71,6 % des cas).
Le nombre de cas d’intoxications chez les mineurs a doublé passant de 16 à 37 cas entre 2020 et 2021 [5].
Ces augmentations alarmantes du nombre de cas d’intoxications au protoxyde d’azote représentent une préoccupation majeure de santé publique. Le nombre de cas d’accidents de la route liés à la consommation de protoxyde d’azote a fortement augmenté depuis quelques années. Les conducteurs ayant consommé du protoxyde d’azote ont une diminution de leurs réflexes accompagnée d’une altération de leurs coordinations motrices, augmentant le risque d’accident de la route. Aux Pays-Bas, le nombre de rapports de police sur les incidents de la route liés à la consommation de ce gaz est passé de 60 à 960 entre 2016 et 2019 [6].
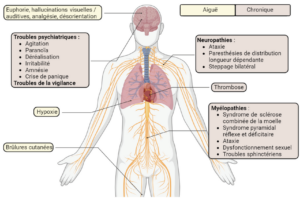
La popularisation croissante du protoxyde d’azote, ainsi que l’augmentation des niveaux de consommation, à la fois en termes de quantité et de fréquence, ont entraîné une augmentation des cas de toxicité. En effet, une consommation de protoxyde d’azote peut entraîner des effets secondaires (figure 2). Ces effets peuvent être dus à une exposition directe ou indirecte mais les mécanismes sous-jacents ne sont pas entièrement élucidés. Le protoxyde d’azote endommage le système nerveux périphérique et central entraînant de graves paralysies chez certains consommateurs, souvent associées à des myélopathies ou à des neuropathies. Les signes cliniques neurologiques sont divers tels que paresthésies, ataxies, scléroses combinées de la moelle [7], etc. Des cas de thromboses sont également rapportés chez certains patients et sont liés à une prise chronique de ce gaz. Des brûlures cutanées de type engelure de contact ont également été observées en relation avec le mode de consommation. En effet la bonbonne est souvent positionnée entre les cuisses des consommateurs pour récupérer le gaz dans un ballon. Toutefois, lors de l’échappement du protoxyde d’azote, la bonbonne se refroidit rapidement (- 40°C) et, avec l’effet anesthésiant de ce gaz, le consommateur n’a pas le réflexe de retrait.
C’est pourquoi les utilisateurs ne ressentent pas la sensation de froid intense, augmentant la gravité des brûlures cutanées [8].
L’addiction au protoxyde d’azote est de moins en moins remise en question. En effet, la consommation chronique de cette substance peut entraîner une tolérance, obligeant les consommateurs à prendre des doses plus élevées pour ressentir les effets euphorisants [9].
Fidalgo et al. ont mis en avant les troubles de l’usage du protoxyde d’azote conformément au diagnostic DSM-5
(Diagnostic and Statistical Manual of Mental Disorders, 5e édition) [10].
Pharmacodynamie
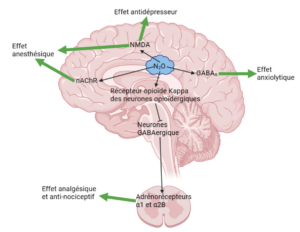
Le mécanisme d’action du protoxyde d’azote n’est pas encore totalement connu. Il agirait sur les récepteurs du glutamate, de l’acide γ-aminobutyrique (GABA pour gamma-aminobutyric acid), des opioïdes kappa, histaminiques, dopaminergiques et adrénergiques α1 et α2B, et produirait ainsi des effets anesthésiques faibles, analgésiques, antinociceptifs, anxiolytiques et antidépresseurs [13] (figure 3).
Ces effets pharmacologiques sont dépendants de la concentration en protoxyde d’azote [11].
Le protoxyde d’azote a un effet antagoniste sur le récepteur du N-méthyl-D-aspartate (NMDA), un sous-type des récepteurs du glutamate, qui serait la principale cible responsable de l’effet anesthésique.
Le protoxyde d’azote n’a qu’un faible effet antagoniste sur les autres soustypes de récepteur du glutamate (acide α-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique (AMPA) et kaïnate). Cet effet anesthésique est aussi induit par une inhibition des récepteurs nicotiniques de l’acétylcholine (nAChR).
L’effet analgésique du protoxyde d’azote est lié à l’activation des récepteurs opioïdes kappa dans la substance grise périaqueducale du mésencéphale. Cette activation induit un blocage des neurones GABAergiques du pont, provoquant une activation des adrénorécepteurs α1 et α2β dans la moelle épinière. L’activation de ces récepteurs est responsable de la diminution de la décharge des neurones de second ordre impliquant une diminution de la transmission d’information de douleur.
L’activation des récepteurs GABAA est impliquée dans l’effet anxiolytique provoqué par le protoxyde d’azote. L’effet antagoniste du protoxyde d’azote sur le récepteur du NMDA provoque également un effet antidépresseur [14].
Impact sur le métabolisme et marqueurs biologiques
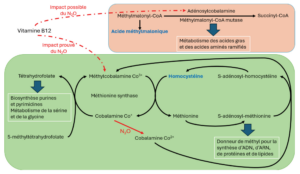
D’un point de vue métabolique, le protoxyde d’azote induit l’oxydation de l’ion cobalt Co+, présent dans le noyau corrinoïde de la vitamine B12, en ion cobalt Co2+, perturbant ainsi les voies métaboliques liées à la vitamine B12, et notamment le cycle des monocarbones [15,16].
La méthionine-synthase, une enzyme cytosolique, utilise la méthylcobalamine-Co3+ comme cofacteur pour le transfert d’un groupement méthyl sur l’homocystéine pour former la méthionine. Ce transfert de méthyl transforme la méthylcobalamine-Co3+ en cobalamine
Co+ qui est régénérée en méthylcobalamine-Co3+ grâce au cycle des folates. La cobalamine-Co+ est utilisée dans le cycle des folates pour la conversion du 5-méthyltétrahydrofolate en tétrahydrofolate [17].
La méthionine, formée grâce à la méthioninesynthase, est activée en S-adénosyl-méthionine pour permettre l’addition de groupement méthyl pour la synthèse d’ADN, d’ARN, de protéines, de lipides et de composants de la myéline. La S-adénosylméthionine permet également la méthylation de la cobalamine-Co2+ issue de l’alimentation ou de l’oxydation de la cobalamine-Co+ par le protoxyde d’azote, en méthylcobalamine-Co3+ par l’action de la méthionine-synthase-réductase [18].
Ainsi, l’oxydation de la cobalamine Co+ par le protoxyde d’azote en cobalamine Co2+, empêche la régénération du méthylcobalamine-Co3+ via le cycle des folates.
Par conséquent, l’activité de la méthionine-synthase est réduite, induisant une accumulation d’homocystéine et une diminution du stock de méthionine. Le cycle des folates, permettant la biosynthèse des purines et des pyrimidines, et qui est impliqué dans le métabolisme de la sérine et de la glycine, est ainsi également impacté [19]. De plus, la méthionine-synthaseréductase utilise la S adénosyl-méthionine afin de restaurer le stock de méthylcobalamine-Co3+ à partir de la cobalamine-Co2+, ce qui, par conséquent, amplifie l’appauvrissement en méthionine et l’accumulation d’homocystéine [18].
Ainsi, le blocage de cette voie métabolique par le protoxyde d’azote induit une accumulation d’homocystéine et une diminution de méthionine. Cette augmentation du taux d’homocystéine peut être utilisée en tant qu’indicateur, bien que peu spécifique d’une toxicité au protoxyde d’azote. En effet, l’augmentation de la concentration plasmatique d’homocystéine est également induite par un déficit en vitamine B6 ou B9, lors d’une insuffisance rénale, lors d’une hypothyroïdie, par la présence d’une tumeur et par la consommation de café ou d’alcool [20].
Il est également supposé que le protoxyde d’azote impacterait une autre forme active de la vitamine B12 : l’adénosylcobalamine. L’adénosylcobalamine est le cofacteur de la méthylmalonyl-CoA-mutase qui permet la conversion du méthylmalonyl-CoA en succinyl-CoA participant au métabolisme des acides gras et des acides aminés ramifiés. Par conséquent, l’inactivation de la vitamine B12, et ainsi le blocage de l’activité enzymatique de la méthylmalonyl-CoAmutase, conduit à une augmentation du métabolisme du méthylmalonyl- CoA en acide méthylmalonique. L’acide méthylmalonique peut être exploité comme indicateur, non spécifique, de la toxicité du protoxyde d’azote [20] (figure 4). Le manque de spécificité est conséquent de l’augmentation du taux plasmatique d’acide méthylmalonique lors d’une insuffisance rénale, lors d’une infection intestinale et pendant certaines maladies métaboliques [21]. De plus, l’élévation de l’acide méthylmalonique n’est pas systématiquement retrouvée en cas d’exposition au protoxyde d’azote [18].
De plus, une augmentation du nombre de consommateurs de protoxyde d’azote prenant une supplémentation en vitamine B12 est observée [21]. Cette supplémentation en vitamine B12 est prise par les consommateurs pensant ainsi réduire les troubles neurologiques, cependant ces troubles sont fonctionnels et non quantitatifs [22]. Cette automédication peut normaliser les concentrations plasmatiques d’acide méthylmalonique ; cependant un taux élevé d’homocystéine peut être maintenu s’il n’y a pas d’arrêt de la consommation de protoxyde d’azote [ 2 3 ] .
Les mécanismes expliquant les atteintes neurologiques par le protoxyde d’azote restent encore à déterminer avec certitude.
Le protoxyde d’azote est capable d’entraîner des phénomènes de démyélinisation et des atteintes axonales. Les lésions démyélinisantes ont généralement un pronostic plus favorable en raison de la possibilité de remyélinisation, tandis que la perte axonale est irréversible. Dans une étude publiée en 2024, les patients ayant un profil démyélinisant présentaient une gravité des signes cliniques plus élevée mais une hyperhomocystémie plus faible en comparaison avec les patients ayant une atteinte axonale. Cette étude a permis de mettre en avant le potentiel rôle des paramètres métaboliques comme marqueurs biologiques afin de comprendre la physiopathologie du protoxyde d’azote [24].
Pharmaco-toxicocinétique
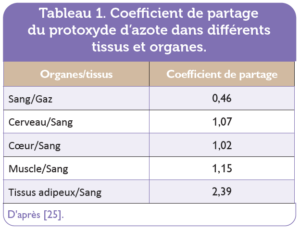
Le protoxyde d’azote a une absorption essentiellement pulmonaire et une diffusion rapide dans l’organisme, avec une distribution dans tous les tissus et particulièrement dans les tissus fortement vascularisés. Le coefficient de partage sang/air du protoxyde d’azote est faible (0,46) et les concentrations en protoxyde d’azote entre les différents organes du corps humain sont relativement proches de celles du sang, entraînant ainsi une saturation rapide en protoxyde d’azote dans le sang et les autres tissus [25]. Les coefficients de partage du protoxyde d’azote de certains organes et tissus/sang sont présentés dans le tableau 1. Les effets pharmacologiques rapides du protoxyde d’azote ainsi que la disparition rapide de ces effets après arrêt de l’exposition sont dus à ses propriétés physico-chimiques. Ce gaz traverse la barrière foetoplacentaire.
Le protoxyde d’azote n’est pas métabolisé par le corps humain. Néanmoins, une faible fraction du protoxyde d’azote absorbé peut être métabolisée par réduction par les bactéries présentes dans le tube digestif [26]. L’élimination est principalement pulmonaire et une proportion minoritaire est éliminée par voies cutanée et urinaire. L’élimination cutanée représente environ 6 % du protoxyde d’azote absorbé et varie en fonction de la température de la peau [27-29]. L’élimination complète de ce gaz dans le sang est atteinte 16 heures après la fin de l’exposition [27].
Le protoxyde d’azote se diffuse dans les cavités contenant de l’air (intestin, pneumocéphale, cavité pleurale).
La diffusion dans l’organisme du protoxyde d’azote étant supérieure à celle du N2, l’inspiration d’une quantité importante de protoxyde d’azote peut conduire à une augmentation du volume et de la pression de ces cavités remplies d’air pouvant ainsi provoquer des troubles tels que météorisme ou hypertension intracrânienne [30].
Perspectives de recherches
Actuellement, lors d’une prise en charge d’une intoxication au protoxyde d’azote aux urgences, un bilan métabolique est réalisé avec un dosage des vitamines B6, B9 (folates) et B12, associé à un dosage de l’acide méthylmalonique et de l’homocystéine. Un bilan biochimique est également effectué pour évaluer la fonction rénale et la fonction hépatique du patient. De nos jours, la littérature montre que l’homocystéine est un marqueur de consommation et l’acide méthylmalonique un marqueur de gravité [31].
Cependant, ces marqueurs biologiques ne sont pas spécifiques aux intoxications au protoxyde d’azote et d’autres facteurs peuvent modifier leurs concentrations tels qu’un defaut d’apport nutritionnel (carence vitaminique B6, B9, B12), une insuffisance rénale, voire une maladie métabolique (CBS, MTHFR, MS).
Il y a donc une réelle nécessité de trouver de nouveaux marqueurs biologiques plus spécifiques des intoxications au protoxyde d’azote qui permettraient une meilleure prise en charge des patients mais aussi le développement de nouvelles cibles thérapeutiques.
Une approche prometteuse consisterait à étudier son impact métabolique. De nos jours, nous savons que le protoxyde d’azote inactive la vitamine B12 et entraîne une cascade de perturbations métaboliques. Des études de métabolomique permettront d’étudier de façon globale les perturbations métaboliques provoquées par le protoxyde d’azote. D’autre part, l’étude des microARNs dérégulés après une exposition au protoxyde d’azote pourrait aussi être une approche intéressante pour identifier de nouveaux biomarqueurs d’effet ou d’exposition. En effet, les microARNs sont relativement stables dans les liquides biologiques et leur détection au niveau systémique peut être le reflet d’atteintes tissulaires.
Ainsi, ces approches innovantes permettront d’identifier des métabolites et/ou des microARNs dérégulés dans le sang de consommateurs de protoxyde d’azote ; ils pourraient constituer des biomarqueurs non invasifs pertinents pour la détection précoce de l’intoxication au protoxyde d’azote.
Ces études devraient ainsi favoriser le développement futur d’un test diagnostique pour le dépistage et le suivi des patients, améliorant la prise en charge des intoxications au protoxyde d’azote.
Nicolas Potier et Benjamin Touzé ont contribué de manière équivalente à la rédaction de cet article.
Déclaration de liens d’intérêts : les auteurs déclarent ne pas avoir de liens d’intérêts.
Tableau 1. Coefficient de partage
Dossier scientifique
◗t L’intoxication au protoxyde d’azote a augmenté de 320 % en France entre 2020 et 2021.
◗t Ce gaz utilisé pour ses effets anesthésiques, anxiolytiques et antidépresseurs est maintenant détourné de manière récréative.
◗t Les effets secondaires connus incluent accidents de la route, troubles neurologiques, thromboses et brûlures cutanées.
◗t L’intoxication est liée à l’inactivation de la vitamine B12 qui augmente les marqueurs fonctionnels nutritionnels tels que homocystéine et acide méthylmalonique.
◗t Les marqueurs biologiques actuels ne sont pas spécifiques de l’intoxication au protoxyde d’azote et ne peuvent attester avec certitude d’une consommation.
◗t La recherche médicale doit être renforcée afin d’identifier de nouveaux biomarqueurs pour améliorer le diagnostic et le suivi.
Points à retenir
[1] Goerig M, Schulte am Esch J. History of nitrous oxide—with special
reference to its early use in Germany. Best Pract Res Clin Anaesthesiol.
2001;15:313-38. -doi.org/10.1053/bean.2001.0165.
[2] Randhawa G, Bodenham A. The increasing recreational use of
nitrous oxide: history revisited. BJA Br J Anaesth. 2016;116:321-4.
doi.org/10.1093/bja/aev297.
[3] NITROUS OXIDE. CAMEO Chemicals. NOAA n.d. https://cameochemicals.
noaa.gov/chemical/8909 (accessed February 5, 2024).
[4] Lahaie E, Andler R, Beck F, Nguyen-Thanh V. Niveaux de consommation
du CBD et du protoxyde d’azote en population adulte en France
métropolitaine en 2022 n.d. Santé publique France. www.santepubliquefrance.
fr/determinants-de-sante/drogues-illicites/documents/enquetesetudes/
niveaux-de-consommation-du-cbd-et-du-protoxyde-d-azote-enpopulation-
adulte-en-france-metropolitaine-en-2022 (accessed March
21, 2024).
[5] ANSM. Actualité – Intoxication au protoxyde d’azote : l’ANSM publie
un document d’aide au diagnostic et à la prise en charge pour les professionnels
de santé. https://ansm.sante.fr/actualites/intoxication-auprotoxyde-
dazote-lansm-publie-un-document-daide-au-diagnosticet-
a-la-prise-en-charge-pour-les-professionnels-de-sante (accessed
February 1, 2024).
[6] van Hulzen D. Toename lachgas-incidenten in verkeer: ballonnetje
moet kunnen, zegt bestuurder. NOS news. 2019. https://nos.nl/
artikel/2297180-toename-lachgas-incidenten-in-verkeer-ballonnetjemoet-
kunnen-zegt-bestuurder (accessed March 28, 2024).
[7] Layzer RB. Myeloneuropathy after prolonged exposure to nitrous oxide.
Lancet. 1978;2(8102):1227-30. doi: 10.1016/s0140-6736(78)92101-3.
[8] Tillet P, Bekara F, Boissiere F et al. Brûlures par l’usage détourné du
protoxyde d’azote en bonbonne. Ann Chir Plast Esthét. 2023;68(3):180-3.
doi.org/10.1016/j.anplas.2023.01.005.
[9] Gillman MA. Nitrous oxide, an opioid addictive agent: Review
of the evidence. Am J Med 1986;81:97-102. doi.org/10.1016/0002-
9343(86)90189-0.
[10] Fidalgo M, Prud’homme T, Allio A et al. Nitrous oxide: What do we
know about its use disorder potential? Results of the French Monitoring
Centre for Addiction network survey and literature review. Subst Abus.
2019;40(1):33-42. doi: 10.1080/08897077.2019.1573210.
[11] Gernez E, Lee GR, Niguet JP et al. Nitrous Oxide Abuse: Clinical
Outcomes, Pharmacology, Pharmacokinetics, Toxicity and Impact on
Metabolism. Toxics. 2023;11(12):962. doi: 10.3390/toxics11120962.
[12] Garakani A, Jaffe RJ, Savla D et al. Neurologic, psychiatric, and
other medical manifestations of nitrous oxide abuse: A systematic review
of the case literature. Am J Addict. 2016;25(5):358-69. doi: 10.1111/
ajad.12372.
[13] Chien WH, Huang MC, Chen LY. Psychiatric and Other Medical
Manifestations of Nitrous Oxide Abuse: Implications From Case Series. J Clin
Psychopharmacol. 2020;40(1):80-3. doi: 10.1097/JCP.0000000000001151.
[14] European Monitoring Centre for Drugs and Drug Addiction.
Recreational use of nitrous oxide : a growing concern for Europe 2022.
www.emcdda.europa.eu/publications/rapid-communication/recreational-
use-nitrous-oxide-growing-concern-europe_en (accessed February
15, 2024).
[15] Blackburn R, Kyaw M, John Swallow A. Reaction of Cob (I)
alamin with nitrous oxide and Cob (III) alamin. J Chem Soc Faraday
Trans 1 Phys Chem Condens Phases. 1977;73:250-5. doi.org/10.1039/
F19777300250.
[16] Ducker GS, Rabinowitz JD. One-Carbon Metabolism in Health and
Disease. Cell Metab. 2017;25(1):27-42. doi: 10.1016/j.cmet.2016.08.009.
[17] McCaddon A, Regland B, Hudson P, Davies G. Functional vitamin
B12 deficiency and Alzheimer disease. Neurology 2002;58:1395-9.
doi.org/10.1212/WNL.58.9.1395.
[18] Lucas A, Noyce AJ, Gernez E et al. Nitrous oxide abuse direct measurement
for diagnosis and follow-up: update on kinetics and impact on metabolic
pathways. Clin Chem Lab Med. 2024. doi: 10.1515/cclm-2023-1252.
[19] Sanders RD, Weimann J, Maze M. Biologic effects of nitrous oxide: a
mechanistic and toxicologic review. Anesthesiology. 2008;109(4):707-22.
doi: 10.1097/ALN.0b013e3181870a17.
[20] Blin J, Guerlais M, Masson D et al. La toxicologie du protoxyde
d’azote. Rev Franc Lab. 2021;2021:48-53. doi.org/10.1016/S1773-
035X(21)00252-5.
[21] Grzych G, Gernez E, Deheul S, Kim I. L’acide méthylmalonique :
un marqueur spécifique de l’intoxication chronique au protoxyde
d’azote ? Rev Médecine Interne. 2022;43:197-8. doi.org/10.1016/j.revmed.
2022.01.001.
[22] Swart G, Blair C, Lu Z, Yogendran S et al. Nitrous oxide-induced
myeloneuropathy. Eur J Neurol. 2021;28(12):3938-44. doi: 10.1111/
ene.15077.
[23] Waclawik AJ, Luzzio CC, Juhasz-Pocsine K, Hamilton V.
Myeloneuropathy from nitrous oxide abuse: unusually high methylmalonic
acid and homocysteine levels. WMJ. 2003;102(4):43-5.
[24] Grzych G, Scuccimarra M, Plasse L et al. Understanding
Neuropathy Features in the Context of Nitrous Oxide Abuse: A Combined
Electrophysiological and Metabolic Approach n.d. Biomedicines.
2024;12(2):429. www.mdpi.com/2227-9059/12/2/429 (accessed
March 27, 2024).
[25] Kreuer S, Bruhn J, Wilhelm W, Bouillon T. Pharmakokinetische/
pharmakodynamische Modelle für Inhalationsanästhetika. Anaesthesist
2007;56:538-56. doi.org/10.1007/s00101-007-1188-7.
[26] Hong K, Trudell JR, O’Neil JR, Cohen EN. Metabolism of
Nitrous Oxide by Human and Rat Intestinal Contents. Anesthesiology.
1980;52:16-9. doi.org/10.1097/00000542-198001000-00004.
[27] Institut national de recherche et de sécurité. Protoxyde d’azote –
Fiche toxicologique n° 267 2018. www.inrs.fr/publications/bdd/fichetox/
fiche.html?refINRS=FICHETOX_267 (accessed February 13, 2024).
[28] Cullen, B.F., Eger, E.I. Diffusion of nitrous oxide, cyclopropane, and
halothane through human skin and amniotic membrane. Anesthesiology.
1972;36:168-73. doi.org/10.1097/00000542-197202000-00019.
[29] Stoelting RK, Eger EI 2nd. Percutaneous loss of nitrous oxide, cyclopropane,
ether and halothane in man. Anesthesiology. 1969;30(3):278-83.
doi: 10.1097/00000542-196903000-00008.
[30] Buhre W, Disma N, Hendrickx J et al. European Society of
Anaesthesiology Task Force on Nitrous Oxide: a narrative review
of its role in clinical practice. Br J Anaesth. 2019;122(5):587-604.
doi: 10.1016/j.bja.2019.01.023.
[31] Grzych G, Deheul S, Gernez E et al. Comparison of biomarker
for diagnosis of nitrous oxide abuse: challenge of cobalamin metabolic
parameters, a retrospective study. J Neurol. 2023;270(4):2237-45.
doi: 10.1007/s00415-023-11570-z.










 Faire un don
Faire un don